

1月3日,我校生命科学学院何晓燕副教授团队在纳米科学材料领域权威期刊《美国化学学会纳米杂志(ACS Nano)》(中科院一区Top,IF=17.1)发表题为《精准推进:可控自协同纳米平台启动焦亡诱导的免疫原性细胞死亡级联用于靶向肿瘤治疗(Advancing Precision: A Controllable Self-Synergistic Nanoplatform Initiating Pyroptosis-Based Immunogenic Cell Death Cascade for Targeted Tumor Therapy)》的学术论文。我校生命科学学院硕士研究生秦玮绩为第一作者,何晓燕副教授和赣南医科大学易小庆副教授为通讯作者,我校为第一完成单位。
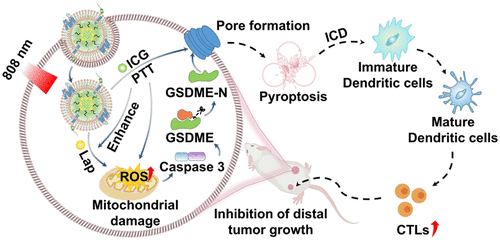
肿瘤微环境(TME)的异质性是成功肿瘤治疗的主要障碍。基于焦亡的免疫原性细胞死亡(ICD)疗法已经成为克服这一挑战的有前景策略。然而,由于恶性肿瘤的内在病理特征,实现高效和精准的焦亡仍然具有挑战性。何晓燕副教授团队设计了一种正反馈增强的焦亡诱导剂,通过特异性激活肿瘤细胞内在分子机制诱导程序化焦亡-ICD级联,实现了更理想的抗肿瘤效果。
在自协同纳米平台中,通过伪装中性粒细胞膜赋予其良好的生物相容性和肿瘤靶向效能,光敏剂吲哚菁绿(ICG)不仅可以将激光照射转化为热能和活性氧(ROS)来特异性诱导焦亡-ICD反应,还可以上调NAD(P)H:醌氧化还原酶1(NQO1),从而催化另一种药物(β-拉帕昆,Lap)生成内源性ROS,以放大焦亡-ICD效果。更重要的是,ICG在激光照射下选择性地产生高热和ROS,而NQO1在肿瘤细胞中特异性过表达,这显示了这两种成分组合在肿瘤治疗中的特异性和精准性。这些特性使该纳米平台在协同肿瘤治疗中显示潜力。通过体内外实验验证了其通过激活Caspase9/GSDME轴来增强焦亡-ICD级联的能力。体内实验结果也证实其有效消除原发性肿瘤的同时,重新调节了异质性TME,并诱导了系统性免疫反应来抑制远处肿瘤。
研究工作得到了国家自然科学基金、安徽省自然科学基金等项目资助。
原文链接:https://doi.org/10.1021/acsnano.3c09499
扫码关注


